En química, la estequiometría (del griego "stoicheion” (elemento) y "métrón” (medida) es el cálculo de las relaciones cuantitativas entre reactivos y productos en el transcurso de una reacción química.
La estequiometría es una herramienta indispensable en la química. Problemas tan diversos como, por ejemplo, la medición de la concentración de ozono en la atmósfera, la determinación del rendimiento potencial de oro a partir de una mina y la evaluación de diferentes procesos para convertir el carbón en combustibles gaseosos, comprenden aspectos de estequiometría.
El primero que enunció los principios de la estequiometría fue Jeremias Benjamin Richter (1762-1807), en 1792. Escribió:
La estequiometría es la ciencia que mide las proporciones cuantitativas o relaciones de masa en la que los elementos químicos que están implicados.
Principio científico
En una reacción química se observa una modificación de las sustancias presentes: los reactivosse modifican para dar lugar a los productos.
A escala microscópica, la reacción química es una modificación de los enlaces entre átomos, por des
plazamientos de electrones: unos enlaces se rompen y otros se forman, pero los átomos implicados se conservan. Esto es lo que llamamos la ley de conservación de la materia (masa), que implica las dos leyes siguientes:
1.- la conservación del número de átomos de cada elemento químico
2.- la conservación de la carga total
Las relaciones estequiométricas entre las cantidades de reactivos consumidos y productos formados dependen directamente de estas leyes de conservación, y están determinadas por la ecuación (ajustada) de la reacción.
Ajustar o balancear una reacción
 |
| Estequiometría, indispensable en la química. |
¿Qué significa ajustar o balancear una reacción? Veamos.
Una ecuación química (que no es más que la representación escrita de una reacción química) ajustada debe reflejar lo que pasa realmente antes de comenzar y al finalizar la reacción y, por tanto, debe respetar las leyes de conservación del número de átomos y de la carga total.
Para respetar estas reglas, se pone delante de cada especie química un número llamado coeficiente estequiométrico, que indica la proporción de cada especie involucrada (se puede considerar como el número de moléculas o de átomos, o de iones o de moles; es decir, la cantidad de materia que se consume o se treansforma).
Por ejemplo:
En la reacción de combustión de metano (CH4), éste se combina con oxígeno molecular(O2) del aire para formar dióxido de carbono (CO2) y agua (H2O).
La reacción sin ajustar (sólo representando los elementos que interactúan) será:
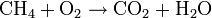
Esta reacción no es correcta, porque no cumple la ley de conservación de la materia. Para el elemento hidrógeno (H), por ejemplo, hay 4 átomos en los reactivos (CH4) y sólo 2 en los productos (H2O). Se ajusta la reacción introduciendo delante de las fórmulas químicas de cada compuesto un coeficiente estequiométrico adecuado.
De esta manera, si se pone un 2 delante del H2O:
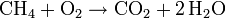
se respeta la conservación para el carbono (C) y el hidrógeno (H), pero no para el oxígeno (O), situación que puede corregirse poniendo otro 2 delante de O2 en los reactivos:
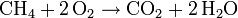
y se obtiene así, finalmente, la reacción ajustada.
Ésta dice que 1 molécula de metano (CH4) reacciona con 2 moléculas de oxígeno molecular (O2) para dar 1 molécula de dióxido de carbono(CO2) y 2 moléculas de agua (H2O). Si verificamos el número de átomos veremos que en ambos lados de la ecuación hay 1 átomo de carbono (C), 4 átomos de hidrógeno (H) y 4 átomos de oxígeno (O). La materia (la cantidad de átomos) se ha conservado una vez terminada la reacción química.
Coeficiente estequiométrico
Ya que arriba lo mencionamos, agregueoms algo más sobre el coeficinte estequiométrico.
Es el coeficiente (un número) que le corresponde a cada especie química (elemento) en una ecuación química dada. En el ejemplo anterior:
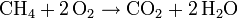
El coeficiente del metano es 1, el del oxígeno 2, el del dióxido de carbono 1 y el del agua 2. Los coeficientes estequiométricos son en principio números enteros, aunque para ajustar ciertas reacciones alguna vez se emplean números fraccionarios. En esencia lo que indica este coeficiente es el número de moléculas de cada sustancia.
Cuando el coeficiente estequiométrico es igual a 1, no se escribe. Por eso, en el ejemplo CH4 y CO2 no llevan ningún coeficiente delante.
Este método del tanteo para fijar el coeficiente estequiométrico sirve bien cuando la reacción es simple. Consiste en fijar arbitrariamente un coeficiente e ir deduciendo los demás haciendo balances a los átomos implicados en la especie inicial. Si aparecen fracciones, se multiplican todos los coeficientes por el mínimo común múltiplo (mcm) de los denominadores
En reacciones más complejas, como es el caso de las reacciones redox, se emplea el método del ion-electrón.
Se recomienda ir balanceando siguiendo el orden: metales, no metales, hidrógenos, oxígenos.
Mezcla/proporciones/condiciones estequiométricas
Cuando los reactivos de una reacción están en cantidades proporcionales a sus coeficientes estequiométricos se dice:
- La mezcla es estequiométrica;
- Los reactivos están en proporciones estequiométricas;
- La reacción tiene lugar en condiciones estequiométricas;
Las tres expresiones tienen el mismo significado.
En estas condiciones, si la reacción es completa, todos los reactivos se consumirán dando las cantidades estequiométricas de productos correspondientes.
Ejemplo
- ¿Qué cantidad de oxígeno es necesaria para reaccionar con 100 gramos de carbono produciendo dióxido de carbono?
Masa atómica del oxígeno = 15,9994.
Masa atómica del carbono = 12,0107.
La reacción es:
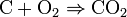
para formar una molécula de dióxido de carbono, hacen falta un átomo de carbono y dos de oxígeno, o lo que es lo mismo, un mol de carbono y dos mol de oxígeno.
1 mol de carbono | | 2 mol de oxígeno |
12,0107 gramos de carbono | | 2 • 15,994 gramos de oxígeno |
100 gramos de carbono | | x gramos de oxígeno |
despejando x:
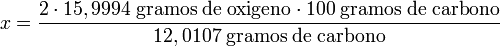
realizadas las operaciones:
x = 266,41 gramos de oxígeno
Ver: Reacción química
Para entender la estequiometría hay que tener claridad conceptual de los siguientes términos:
Elementos -----> Átomos ------> Símbolos
Compuestos -----> Moléculas ------> Fórmulas
Reacciones Químicas (cambios químicos) -------> Ecuaciones Químicas
Símbolo es la representación gráfica de un elemento. El símbolo de un elemento representa no solamente su nombre, sino también un átomo o un número prefijado (“mol”) de átomos de ese elemento.
Fórmula es la representación gráfica de un compuesto. La fórmula de una sustancia indica su composición química.
Ecuación Química es la representación gráfica de un cambio químico. Una reacción química siempre supone la transformación de una o más sustancias en otra u otras; es decir, hay un reagrupamiento de átomos o iones, y se forman otras sustancias.
Peso Atómico: Se puede definir como la masa en gramos de un mol de átomos. En términos más específicos, el peso atómico es el peso total de las masas de los isótopos naturales del elemento.
La estequiometría se refiere a las cantidades de reaccionantes y productos comprendidos en las reacciones químicas. Para una reacción hipotética;
Surgen preguntas como estas ¿ Cuanto se necesita de A para que reaccione con x gramos de B? ¿ Cuanto se producirá de C en la reacción de A con x gramos de B? ¿ Cuanto se producirá de B junto con Y gramos de C?. Las cantidades químicas es decir, el"cuanto" de las preguntas anteriores se pueden medir de diferentes maneras. Los sólidos generalmente se miden en gramos, los líquidos en mililitros y los gases en litros. Todas estas unidades de cantidad se pueden expresar también en otra unidad, el "mol".
FACTORES QUÍMICOS DE CONVERSIÓN
La razón de dos cantidades cualesquiera en la ecuación balanceada nos da el " factor químico" de conversión, que permite pasar de las moléculas de una sustancia al numero equivalente de moléculas de otras sustancia implicada en la reacción, a apartir de la ecuación balanceada;
Se puede escribir los siguientes factores químicos de conversión

De la misma manera como las fórmulas pueden interpretarse directamente en términos de moles o de moléculas. Para demostrar esto, multipliquese cada término en ambos miembros de la ecuación anterior por el numero de Avogadro,6.02 x 10 23. Esto no altera la igualdad. la ecuación resultante es:
4( 6.02 x 1023 ) FeS | + | 7( 6.02 x 1023 ) O2 | → | 2( 6.02 x 1023 ) Fe2O3 | + | 4( 6.02 x 1023 ) SO2 |
Observe que 6.02 x 1023 moléculas de una sustancia son exactamente 1 mol de esa sustancia. Así se puede sustituir este numero por su equivalente en moles y la ecuación se convierte en :

Siguiendo un razonamiento similar al usado con las moléculas, podemos obtener factores químicos en términos de moles. Así, tenemos los siguientes factores de conversión.
RELACIÓN EN PESO OBTENIDAS DE LAS ECUACIONES
Existe una ley llamada ley de la composición definida que establece que cuando las sustancias reaccionara para formar compuestos lo hacen en relaciones definidas de masas. por ejemplo:
4FeS | + | 7O2 | → | 2Fe2O3 | + | 4SO2 |
| 4 moles | | 7 moles | | 2 moles | | 4 moles |
| 4 x 87.91 g | | 7 x 32 g | | 2 x 159.69 g | | 4 x 64.06 g |
muestra que 4 moles de FeS ( 4 x 87.091 g de FeS) reaccionan con 7 moles de O2(7 x 32 g de O2) para formar 2 moles de Fe2O3 y 4 moles de SO2 ( 4 x 64.06 g ) de los productos ( 319.38 + 256.24) ( ley de la conservación de la masa)
1. Cálculos masa a masa
La relación entre la masa de un reactante y la masa correspondiente de un producto es uno de los problemas de mayor frecuencia en química. Hay varios métodos para resolver este tipo de problemas.
EJEMPLO:
(a) Método de las proporciones :
Se procede a escribir la ecuación química equilibrada :
Se hallan los pesos mol de las sustancias problema :
Peso de 1 mol de KCl3 = 122,55 g
Peso de 1 mol de O2 = 32 g
De acuerdo con la ecuación :
245,10 g de KClO3 producen 96 g de O2
30 g de KClO3 X

(b) Método del factor de la conversión :
Resumiendo la información cuantitativa que da la ecuación :
| 2KClO3 | → | 2KCl | + | 3O2 |
| 245,10 g | | 96 g | | |
Se puede obtener un factor de conversión para pasar gramos de KClO3 ( sustancia conocida ) a gramos de oxígeno ( sustancia problema ).
El factor es :

Se multiplica la cantidad de sustancia dada, KClO3, por el factor de conversión para hallar la cantidad buscada :

2. Cálculos mol-mol
Los problemas estequiometrícos más simples son aquellos en los cuales se calcula el número de moles de una sustancia, que han reaccionado con, o se producen a partir de un cierto número de moles de otra sustancia.
EJEMPLO:
La ecuación equilibrada para esta reacción es :
La ecuación equilibrada nos indica :
1 mol N2 reacciona con 3 moles H2
X moles N2 reaccionan con 0.75 moles H2
X = 0.25 moles de N2
3. Cálculos con reactivo límite
Generalmente en el laboratorio es difícil tomar las cantidades precisas de cada uno de los reactivos para las diferentes experiencias, ocasionando el exceso de uno de los reactivos . Los cálculos para determinar la cantidad de producto esperado se realizan teniendo en cuenta la sustancia que se consume en forma total o reactivo límite.
EJEMPLO:
La ecuación equilibrada es :
Lo primero que se debe hacer es determinar cuál es el reactivo límite. De acuerdo con la ecuación tenemos que :
39,98 g de NaOH se combinan con 36,45 g de HCl
15 g de NaOH se combinarán con X
X = 13,67 g de HCl
Significa que en la reacción únicamente 15 g de NaOH requieren combinarse con 13,67 g de HCL, quedando en exceso 1,33 g de HCl. Por tanto, el reactivo límite es el NaOH y con esa cantidad problema debemos determinar la cantidad de producto obtenido :
39,98 g de NaOH producen 58,43 g de NaCl
15 g de NaOH producirían X g de NaCl
* Reactivo LimitanteLos cálculos se basan en la sustancia de la que había menor cantidad, denominada "reactivo limitante". Antes de estudiar el concepto de reactivo limitante en ESTEQUIOMETRIA, vamos a presentar la idea básica mediante algunos ejemplos sencillos no químicos.
* Suponga que tiene 20 lonchas de jamón y 36 rebanadas de pan, y que quiere preparar tantos bocadillos como sea posible con una loncha de jamón y dos rebanadas de pan por bocadillo. Obviamente sólo podemos preparar 18 bocadillos, ya que no hay pan para más. Entonces, el pan es el reactivo limitante y las dos lonchas de jamón demás son el "exceso de reactivo".
* Suponga que una caja contiene 93 pernos, 102 tuercas y 150 arandelas. ¿Cuántos grupos de un perno, una tuerca y dos arandelas pueden formarse? Setenta y cinco, ya que se emplean todas las arandelas. Por tanto, éstas serán el "reactivo limitante". Aún quedarían 18 pernos y 27 tuercas, que son los reactivos en "exceso".
¿Qué masa de CO2 se producirá al reaccionar 8,0 gramos de CH4 con 48 gramos de O2 en la combustión del metano?
Reproduzcamos la reacción ajustada:
Para ver la fórmula seleccione la opción "Descargar" del menú superior
1 mol 2 moles 1 mol 2 moles
16 g 64 g 44 g 36 g
Con nuestros datos se calcula el número de moles de cada uno.
Para ver la fórmula seleccione la opción "Descargar" del menú superior
La ecuación ajustada indica la relación de los reactivos al reaccionar:
1 mol de CH4 a 2 moles de O2
0,5 mol de CH4 a 1 mol de O2
pero como realmente tenemos:
0,5 mol de CH4 a 1,5 de O2
Entonces una vez que han reaccionado 0,5 moles de CH4 con 1 mol de O2, la reacción se detiene por agotamiento del CH4, y quedarían 0,5 moles de O2 de exceso. El CH4 es el reactivo limitante y sobre él deben basarse los cálculos.
RENDIMIENTO DE LAS REACCIONES QUÍMICAS
Muchas reacciones no se efectúan en forma completa; es decir, los reactivos no se convierten completamente en productos. El término "rendimiento" indica la cantidad de productos que se obtiene en una reacción.
Para ver la fórmula seleccione la opción "Descargar" del menú superior
Consideremos la preparación de nitrobenceno, C6H5NO2, por reacción de ácido nítrico, HNO3, en exceso con una cantidad limitada de benceno, C6H6. La ecuación ajustada de la reacción es :
C6H6 + HNO3 C6H5NO2 + H2O
1 mol 1 mol 1mol 1 mol
78,1 g 63,0 g 123,1 g 18,0 g
Una muestra de 15,6 gramos de C6H6 reacciona con HNO3 en exceso y origina 18,0 g de C6H5NO2. ¿Cuál es el rendimiento de esta reacción con respecto al C6H5NO2? Calcúlese en primer lugar el rendimiento teórico del C6H5NO2 de acuerdo a la ESTEQUIOMETRIA.
Esto significa que si todo el C6H6 se convirtiera en C6H5NO2, se obtendrían 24,6 de C6H5NO2 (rendimiento del 100%); sin embargo, la reacción produce solamente 18,0 gramos de C6H5NO2, que es mucho menos que el 100%.
Reactivo Limitante
Cuando se ha ajustado una ecuación, los coeficientes representan el número de átomos de cada elemento en los reactivos y en los productos. También representan el número de moléculas y de moles de reactivos y productos.
Cuando una ecuación está ajustada, la estequiometría se emplea para saber las moles de un producto obtenidas a partir de un número conocido de moles de un reactivo. La relación de moles entre reactivo y producto se obtiene de la ecuación ajustada. A veces se cree equivocadamente que en las reacciones se utilizan siempre las cantidades exactas de reactivos. Sin embargo, en la práctica lo normal suele ser que se use un exceso de uno o más reactivos, para conseguir que reaccione la mayor cantidad posible del reactivo menos abundante.
Reactivo limitante
Cuando una reacción se detiene porque se acaba uno de los reactivos, a ese reactivo se le llama reactivo limitante.
Aquel reactivo que se ha consumido por completo en una reacción química se le conoce con el nombre de reactivo limitante pues determina o limita la cantidad de producto formado.
Reactivo limitante es aquel que se encuentra en defecto basado en la ecuación química ajustada.
Ejemplo 1:
Para la reacción:
¿Cuál es el reactivo limitante si tenemos 10 moléculas de hidrógeno y 10 moléculas de oxígeno?
Necesitamos 2 moléculas de H2 por cada molécula de O2
Pero tenemos sólo 10 moléculas de H2 y 10 moléculas de O2.
La proporción requerida es de 2 : 1
Pero la proporción que tenemos es de 1 : 1
Es claro que el reactivo en exceso es el O2 y el reactivo limitante es el H2
Como trabajar con moléculas es lo mismo que trabajar con moles.
Si ahora ponemos 15 moles de H2 con 5 moles de O2 entonces como la estequiometría de la reacción es tal que 1 mol de O2 reaccionan con 2 moles de H2, entonces el número de moles de O2 necesarias para reaccionar con todo el H2 es 7,5, y el número de moles de H2 necesarias para reaccionar con todo el O2 es 10.
Es decir, que después que todo el oxígeno se ha consumido, sobrarán 5 moles de hidrógeno. El O2 es el reactivo limitante
Una manera de resolver el problema de cuál es el reactivo es el limitante es:
Calcular la cantidad de producto que se formará para cada una de las cantidades que hay de reactivos en la reacción.
El reactivo limitante será aquel que produce la menor cantidad de producto.
Ejemplo 2:
Se necesita un cierre, tres arandelas y dos tuercas para construir una baratija. Si el inventario habitual es 4,000 cierres, 12,000 arandelas y 7,000 tuercas. ¿Cuantas baratijas se pueden producir?
La ecuación correspondiente será:
En esta reacción, 1 mol de cierres, 3 moles de arandela y 2 moles de tuercas reaccionan para dar 1 mol de baratijas.
1) Divide la cantidad de cada reactivo por el número de moles de ese reactivo que se usan en la ecuación ajustada. Así se determina la máxima cantidad de baratijas que pueden producirse por cada reactivo.
* Cierres: 4,000 / 1 = 4,000
* Arandelas: 12,000 / 3 = 4,000
* Tuercas: 7,000 / 2 = 3,500
Por tanto, el reactivo limitante es la tuerca.
2) Determina el número de baratijas que pueden hacerse a partir del reactivo limitante. Ya que el reactivo limitante es la tuerca, el máximo número de baratijas que pueden hacerse viene determinado por el número de tuercas. Entran dos tuercas en cada baratija, de modo que el número de bsratijas que pueden producirse, de acuerdo con la estequiometría del proceso es:
7,000 / 2 = 3,500 baratijas
Ejemplo 3:
Considere la siguiente reacción:
Supongamos que se mezclan 637,2 g de NH3 con 1142 g de CO2. ¿Cuántos gramos de urea [(NH2)2CO] se obtendrán?
1) Primero tendremos que convertir los gramos de reactivos en moles:
637,2 g de NH3 son 37,5 moles
1142 g de CO2 son 26 moles
2) Ahora definimos la proporción estequiométrica entre reactivos y productos:
* a partir de2 moles de NH3 se obtiene1 mol de (NH2)2CO
* a partir de 1 mol de CO2 se obtiene 1 mol de (NH2)2CO
3) Calculamos el número de moles de producto que se obtendrían si cada reactivo se consumiese en su totalidad:
* a partir de37,5 moles de NH3 se obtienen 18,75 moles de (NH2)2CO
* a partir de 26 moles de CO2 se obtienen 26 moles de (NH2)2CO
4) El reactivo limitante es el (NH3) y podremos obtener como máximo 18.75 moles de urea.
5) Y ahora hacemos la conversión a gramos:
18,75 moles de (NH2)2CO son 1125 g.
Rendimiento
Se cree equivocadamente que las reacciones progresan hasta que se consumen totalmente los reactivos, o al menos el reactivo limitante.
La cantidad real obtenida del producto, dividida por la cantidad teórica máxima que puede obtenerse (100%) se llama rendimiento.
Rendimiento teórico
La cantidad de producto que debiera formarse si todo el reactivo limitante se consumiera en la reacción, se conoce con el nombre de rendimiento teórico.
A la cantidad de producto realmente formado se le llama simplemente rendimiento o rendimiento de la reacción. Es claro que siempre se cumplirá la siguiente desigualdad
Rendimiento de la reacción ≦ rendimiento teórico
Razones de este hecho:
* es posible que no todos los productos reaccionen
* es posible que haya reacciones laterales que no lleven al producto deseado
* la recuperación del 100% de la muestra es prácticamente imposible
Una cantidad que relaciona el rendimiento de la reacción con el rendimiento teórico se le llama rendimiento porcentual o % de rendimiento y se define así:
Ejemplo:
La reacción de 6,8 g de H2S con exceso de SO2, según la siguiente reacción, produce 8,2 g de S. ¿Cual es el rendimiento?
(Pesos Atómicos: H = 1,008, S = 32,06, O = 16,00).
En esta reacción, 2 moles de H2S reaccionan para dar 3 moles de S.
1) Se usa la estequiometría para determinar la máxima cantidad de S que puede obtenerse a partir de 6,8 g de H2S.
(6,8/34) x (3/2) x 32 = 9,6 g
2) Se divide la cantidad real de S obtenida por la máxima teórica, y se multiplica por 100.
(8,2/9,6) x 100 = 85,4%
Rendimiento con Reactivos Limitantes
Ejemplo:
La masa de SbCl3 que resulta de la reacción de 3,00 g de antimonio y 2,00 g de cloro es de 3,65 g. ¿Cuál es el rendimiento?
(Pesos Atómicos: Sb = 121,8, Cl = 35,45)
En esta reacción, 1 mol de Sb4 y 6 moles de Cl2 reaccionan para dar 4 moles de SbCl3.
1) Calcular el número de moles que hay de cada reactivo:
Peso Molecular del Sb4: 487,2
número de moles de Sb4 = 3/487,2 = 0,006156
Peso Molecular del Cl2: 70,9
número de moles de Cl2 = 2/70,9 = 0,0282
2) Comparar con la relación de coeficientes en la ecuación ajustada. La relación es de 1 mol de Sb4 a 6 moles de Cl2. Usando la estequiometría:
0,00656/0,0282 = 1/4,3 > 1/6
de modo que el reactivo limitante es el Cl2. Nosotros sólo tenemos 0,0282 moles de Cl2.
3) Usar la estequiometría para determinar la máxima cantidad de SbCl3 que puede obtenerse con 2,00 g de Cl2 (el reactivo limitante).
4) Dividir la cantidad real de SbCl3 obtenida por la máxima teórica y multiplicar por 100.
(3,65/4,29) x 100 = 85,08%
5- Una de las maneras de eliminar el NO en las emisiones de humos es hacerle reaccionar con amoníaco:
4 NH3 (g) + 6 NO (g) 5 N2 + 6 H2O
A) Suponiendo que el rendimiento de la reacción sea del 100% : a) ¿Cuántos litros de N2 medidos en condiciones normales se obtendrán a partir de 17g de NH3?; b) ¿Cuántos gramos de nitrógeno y de agua se obtendrán a partir de 180g de NO y 180g de NH3?
B) Si partiendo de 68g de NH3 se obtienen 68g de H2O: a)¿ Cuál es el rendimiento de la reacción?; b)¿Cuántos gramos de N2 se obtendrán?
6- El freón-12, gas empleado como refrigerante, se prepara por la reacción siguiente:
3CCl4 + 2SbF3 3CCl2F2(freón) + 2SbCl3
A) Si se mezclan 150g de CCl4 con 100g de SbF3 se pide : a)¿Cuántos gramos de CCl2F2 pueden formarse como máximo?; b)¿Cuántos gramos y de qué reactivo sobrarán, una vez que la reacción termine?
B) Si el rendimiento fuese de un 75%: a)¿Qué cantidad de Freón-12 se obtendría?; ¿Qué cantidad de cloruro antimonioso se obtendría?
7- El bifenilo se obtiene según la reacción de Ullmann entre el yoduro de fenilo y cobre según la reacción:
2C6H5I + Cu C6H5-C6H5 + I2Cu
a)¿Cuántos gramos de yoduro de fenilo y de cobre deben emplearse para obtener 40 g de bifenilo suponiendo que el rendimiento fuera cuantitativo?
b) Si partimos de 204 g de yoduro de fenilo y 63,5 g de cobre, ¿cuánto puede obtenerse como máximo de bifenilo?¿Qué reactivo sobrará y qué cantidad?¿Cuál será el rendimiento si en realidad se obtienen 50 g de bifenilo?
8- Si se mezclan 15 g de 1-butino con 70 g de bromuro de hidrógeno, indicar: a)¿cuál será el reactivo limitante? b) ¿Cuántos gramos de 2,2-dibromobutano pueden formarse? c) ¿Qué cantidad se obtendría si el rendimiento fuese de un 75%?
Problemas a resolver
1. Una muestra de dicromato de amonio, contiene 1.81 x 1024 átomos de hidrógeno ¿cuántos gramos de nitrógeno hay en ella?.
2. ¿Cuántas moléculas de agua hay en dos mL de una disolución de HCl , cuya densidad y % en masa son 1.19 g/mL y 37% en masa respectivamente?.
3. Una planta de producción de NaOH, concentra una disolución que contiene 88% en masa de agua y 12% en masa de NaOH. Si la densidad de esta disolución es de 1.1309 g/mL:
a) ¿Cuántos iones OH hay por mL de disolución?
b) ¿Cuántos moles de iones sodio hay por mL de disolución?
4. ¿Qué volumen (mL) de una disolución de etanol (C2H6O) que tiene 94% de pureza en masa, contiene 0.2 moles de etanol? . La densidad de la disolución es 0.807 g/mL.
¿Cuántos átomos de hidrógeno hay en 10 mL de etanol? (considera que es una disolución acuosa).
5. Una aleación que contiene hierro (54.7% en masa), níquel (45.0 %) y manganeso (0.3%) tiene una densidad de 8.17 gramos sobre cm3
a) ¿Cuántas moles de hierro hay en un bloque de aleación que mide 10cm x 20cm x 15cm?.
b) ¿Cuántos átomos de manganeso hay en la mitad del bloque que se menciona en el inciso anterior?.
6. Una muestra de 50 gramos de calcopirita contiene 28 gramos de CuFeS2. ¿Cuál es el porcentaje de cobre en la calcopirita?.
8. Al quemar una muestra de un hidrocarburo se producen 12.28 g de CO2 y 5.86 g de agua
a) ¿Cuántos gramos de muestra se quemaron?
b) ¿Cuál es la composición porcentual de cada elemento en el compuesto?
c) ¿Cuál es la fórmula empírica del compuesto orgánico?
9. Hay un oxiácido orgánico muy abundante en limones, naranjas y toronjas, cuando se queman 5 gramos de este ácido se producen 6.875 gramos de bióxido de carbono y 1.875gramos de agua, si 0.25 moles de este compuesto equivalen a 48 gramos.
a) ¿Cuál es la composición porcentual del oxiácido?
b) ¿Cuál es la fórmula mínima del ácido?
c) ¿Cuál es la fórmula molecular del compuesto orgánico?
10. El mentol, la sustancia orgánica que podemos oler en las pastillas mentoladas para la tos, se compone de carbono, hidrógeno y oxígeno. Una muestra de 100.1 mg de mentol se quema en presencia de oxígeno, produciendo 282.9 mg de bióxido de carbono y 115.9 mg de agua.
a) Determina la composición porcentual de cada elemento en la sustancia orgánica.
b) ¿Cuál es la fórmula mínima del mentol?.
c) Si 15.6 gramos son 0.1 moles del compuesto ¿Cuál es su fórmula molecular?.
11. Se determinó que un compuesto orgánico contiene solo 3 elementos: carbono, hidrógeno y cloro. Cuando se quemó por completo en el aire una muestra de 1.5 gramos del compuesto, se produjeron 3.52 g de CO2. En otro experimento, el cloro de una muestra de un gramo del compuesto, se transformó en 1.27 gramos de cloruro de plata.
a) ¿Cuál es la masa en gramos que hay de cada elemento en 1.5 gramos de muestra del compuesto mencionado?
b) ¿Cuál es la composición porcentual de cada elemento en el compuesto?
c) ¿Cuál es la fórmula mínima para esta sustancia orgánica?
12. La alicina es el compuesto que proporciona el olor característico al ajo. Al realizar un análisis de este compuesto se encuentra que tiene la siguiente composición porcentual: C:44.4%, H:6.21%, S:39.5%, O:9.86%. También se encuentra que su masa molar es igual
a 162 g/mol. Calcula la fórmula empírica y la fórmula molecular de este compuesto.
13. En un experimento se obtuvo un compuesto de hierro y oxígeno que tienen 27.65% de oxígeno y 72.34% de hierro. Obtenga la fórmula mínima del compuesto.
14. En una reacción de combustión se queman 3 gramos de un compuesto orgánico, si se producen 8 gramos de CO2 ¿Qué porcentaje en masa del compuesto es carbono?.
15. Determina el porcentaje en masa de hierro que hay en el cloruro férrico hexahidratado.
16. La vitamina E tiene 11.21% en masa de hidrógeno. Si un mol de vitamina E contiene 3.01 x 1025átomos de hidrógeno;
a) ¿Cuál es la masa molar de la vitamina E?
b) ¿Cuántos átomos de hidrógeno hay por molécula de vitamina ECálculos estequiométricos: Consideraciones previas.
El ejercicio se basa en la siguiente reacción: N2 + 3 H2 → 2 NH3
1. Si tenemos un mol de N2, ¿con cuántos moles de H2 reaccionan?
a) 1 mol
b) 2 moles
c) 3 moles
d) 4 moles
e) 6 moles
f) Ninguna de las respuestas
2. Si tenemos un mol de N2, ¿con cuántos moles de NH3 se producen?
a) 1 mol
b) 2 moles
c) 3 moles
d) 4 moles
e) 6 moles
f) Ninguna de las respuestas
3. Si tenemos dos moles de N2, ¿con cuántos moles de H2 reaccionan?
a) 1 mol
b) 2 moles
c) 3 moles
d) 4 moles
e) 6 moles
f) Ninguna de las respuestas
4. Si tenemos un mol de N2, ¿con cuántos moles de NH3 se producen?
a) 1 mol
b) 2 moles
c) 3 moles
d) 4 moles
e) 6 moles
f) Ninguna de las respuestas
Problemas estequiométricos
1) En un alto horno, el mineral de hierro, Fe2O3, se convierte en hierro mediante la reacción:
Fe2O3 (s) + 3 CO (g) -----> 2 Fe (l) + 3 CO2 (g)
a) ¿Cuántos moles de monóxido de carbono se necesitan para producir 20 moles de hierro?
b) ¿Cuántos moles de CO2 se desprenden por cada 10 moles de hierro formado?
2) Carbonato de calcio se descompone por la acción del calor originando óxido de calcio y dióxido de carbono.
a) Formula la reacción que tiene lugar y ajústala.
b) Calcula qué cantidad de óxido de calcio se obtiene si se descompone totalmente una tonelada de carbonato de calcio.
3) ¿Qué cantidad de gas cloro se obtiene al tratar 80 g de dióxido de manganeso con exceso de HCl según la siguiente reacción? MnO2 + 4 HCl ---> MnCl2 + 2 H2O + Cl2
Solución: 62,24 g de Cl2
4) La sosa cáustica, NaOH, se prepara comercialmente mediante reacción del NaCO3 con cal apagada, Ca(OH)2. ¿Cuántos gramos de NaOH pueden obtenerse tratando un kilogramo de Na2CO3 con Ca(OH)2?
Nota: En la reacción química, además de NaOH, se forma CaCO3.
5) Cuando se calienta dióxido de silicio mezclado con carbono, se forma carburo de silicio (SiC) y monóxido de carbono. La ecuación de la reacción es:
SiO2 (s) + 3 C (s) -----> SiC (s) + 2 CO (g)
Si se mezclan 150 g de dióxido de silicio con exceso de carbono, ¿cuántos gramos de SiC se formarán?
6) Calcular la cantidad de cal viva (CaO) que puede prepararse calentando 200 g de caliza con una pureza del 95% de CaCO3.
CaCO3 ---> CaO + CO2
7) La tostación es una reacción utilizada en metalurgia para el tratamiento de los minerales, calentando éstos en presencia de oxígeno. Calcula en la siguiente reacción de tostación:
2 ZnS + 3 O2 à 2 ZnO + 2 SO2
La cantidad de ZnO que se obtiene cuando se tuestan 1500 kg de mineral de ZnS de una riqueza en sulfuro (ZnS) del 65%. Datos: MZn= 65,4 u. ; MS = 32,1 u. ; MO = 16 u
8) ¿Qué masa, qué volumen en condiciones normales, y cuántos moles de CO2 se desprenden al tratar 205 g de CaCO3 con exceso de ácido clorhídrico según la siguiente reacción?
CaCO3 + 2 HCl à CaCl2 + H2O + CO2
9) Se tratan 4,9 g de ácido sulfúrico con cinc. En la reacción se obtiene sulfato de cinc e hidrógeno.
a) Formula y ajusta la reacción que tiene lugar.
b) Calcula la cantidad de hidrógeno desprendido.
c) Halla qué volumen ocupará ese hidrógeno en condiciones normales.
10) ¿Qué volumen de hidrógeno medido a 30 °C y 780 mm de Hg se obtiene al tratar 130 g de Zn con exceso de ácido sulfúrico?
11) Tenemos la siguiente reacción química ajustada: H2SO4 + Zn à ZnSO4 + H2
¿Qué volumen de hidrógeno se puede obtener a partir de 10 g de Zn, si las condiciones del laboratorio son 20 °C y 0,9 atm de presión? Datos: MZn = 65,4 u. ; MS = 32,1 u. ; MO = 16 u. ; MH = 1 u.
12) El acetileno, C2H2, arde en presencia de oxígeno originando dióxido de carbono y agua.
a) Escribe la ecuación química de la reacción.
b) ¿Qué volumen de aire (21% O2), que se encuentra a 17 °C y 750 mm de Hg, se necesita para quemar 2 kg de acetileno?
13) Mezclamos 1 litro de flúor con suficiente cantidad de monóxido de nitrógeno, medidos ambos en condiciones normales. ¿Cuántos gramos de FNO se formarán? La ecuación de la reacción que tiene lugar es
F2 (g) + 2 NO (g) à 2 FNO (g)